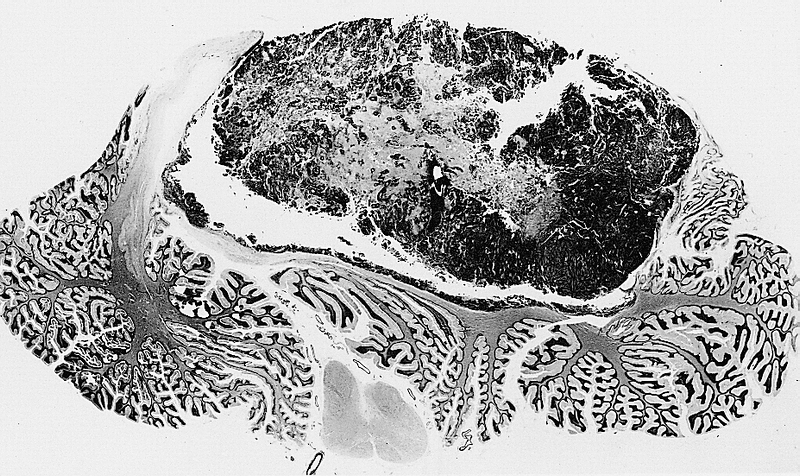
La perdita parziale o totale della proteina NBS1 può avere effetti opposti: nel primo caso può favorire la crescita del medulloblastoma, nel secondo contrastarla
Tra i fattori che possono portare all’insorgenza di alcuni tumori neurologici, come certe forme di medulloblastoma, hanno un ruolo importante la proteina NBS1 e il suo dosaggio. Differenze nel numero dei relativi alleli presenti nel genoma, e quindi nei loro livelli di espressione, possono determinare se il complesso proteico a cui la proteina appartiene svolge un’azione pro- o antitumorale.
È quanto ha scoperto un gruppo di ricercatori guidato da Giuseppe Giannini dell’Università “La Sapienza” di Roma, in uno studio sostenuto da Fondazione AIRC, i cui risultati sono stati pubblicati sulla rivista Neuropathology and Applied Neurobiology.
Il complesso proteico studiato è composto da tre proteine denominate MRE11, RAD50 e NBS1 e nell’insieme è chiamato, in sigla, MRN. «Il complesso MRN ha un ruolo importante nella riparazione dei danni al DNA provocati dallo stress replicativo. Nello studio ci siamo concentrati in particolare su tumori dipendenti da MYCN, un oncogene noto per il ruolo importante nelle prime fasi della trasformazione tumorale nelle cellule neuronali», spiega Giannini.
Il gruppo ha valutato gli effetti della perdita parziale o totale della proteina NBS1, scoprendo che le ricadute sono diverse a seconda che i livelli di espressione siano pieni, parziali o nulli.
«Abbiamo scoperto che un’azione pro-tumorigenica segue a una perdita parziale di questa proteina. Inaspettatamente, invece, quando la perdita di NBS1 è totale si ha invece un’azione anti-tumorale», continua Giannini, che a Roma dirige il laboratorio di genetica molecolare del cancro del Dipartimento di medicina molecolare della Sapienza e il laboratorio di oncologia molecolare del Policlinico Umberto I.
La ricerca è stata condotta con cellule primarie di granuli cerebellari in coltura e con animali di laboratorio. «L’uso di animali per questo tipo di studi è indispensabile e per ora insostituibile», dice ancora il professore. «È chiaro che non abbiamo piacere a usare gli animali: tutte le volte che possiamo, ci serviamo di strategie alternative. A oggi, tuttavia, per generare questo tipo di conoscenze, come osservare gli effetti del dosaggio genico sulla predisposizione alla formazione del cancro, non abbiamo alternative valide all’impiego di animali di laboratorio».
I risultati ottenuti dallo studio potrebbero in futuro aprire la strada a nuovi approcci terapeutici. «Abbiamo osservato che colpire il complesso MRN nei tumori neuronali già sviluppati ha risvolti terapeutici importanti sia in cellule in coltura sia in animali di laboratorio», dice Giannini. L’approccio scelto si inserisce in un filone più ampio che sta già avendo importanti applicazioni in altri tipi di tumori e che punta all’utilizzo di molecole in grado di interferire con i meccanismi di riparazione del DNA nelle cellule tumorali. «Abbiamo condotto un altro studio in cui abbiamo usato combinazioni di farmaci di questo tipo già in uso clinico, i cosiddetti inibitori di PARP e di CHK1, che si sono rivelati promettenti. La nostra è tuttavia una ricerca sperimentale, che richiederà studi clinici per validare l’approccio negli esseri umani», conclude Giannini.