La scoperta potrebbe aprire le porte a nuove strategie per il trattamento delle eventuali recidive dopo trapianto di midollo osseo. Fondamentale l’utilizzo di animali di laboratorio per ottenere risultati che avvicinano la possibilità di sperimentazione clinica
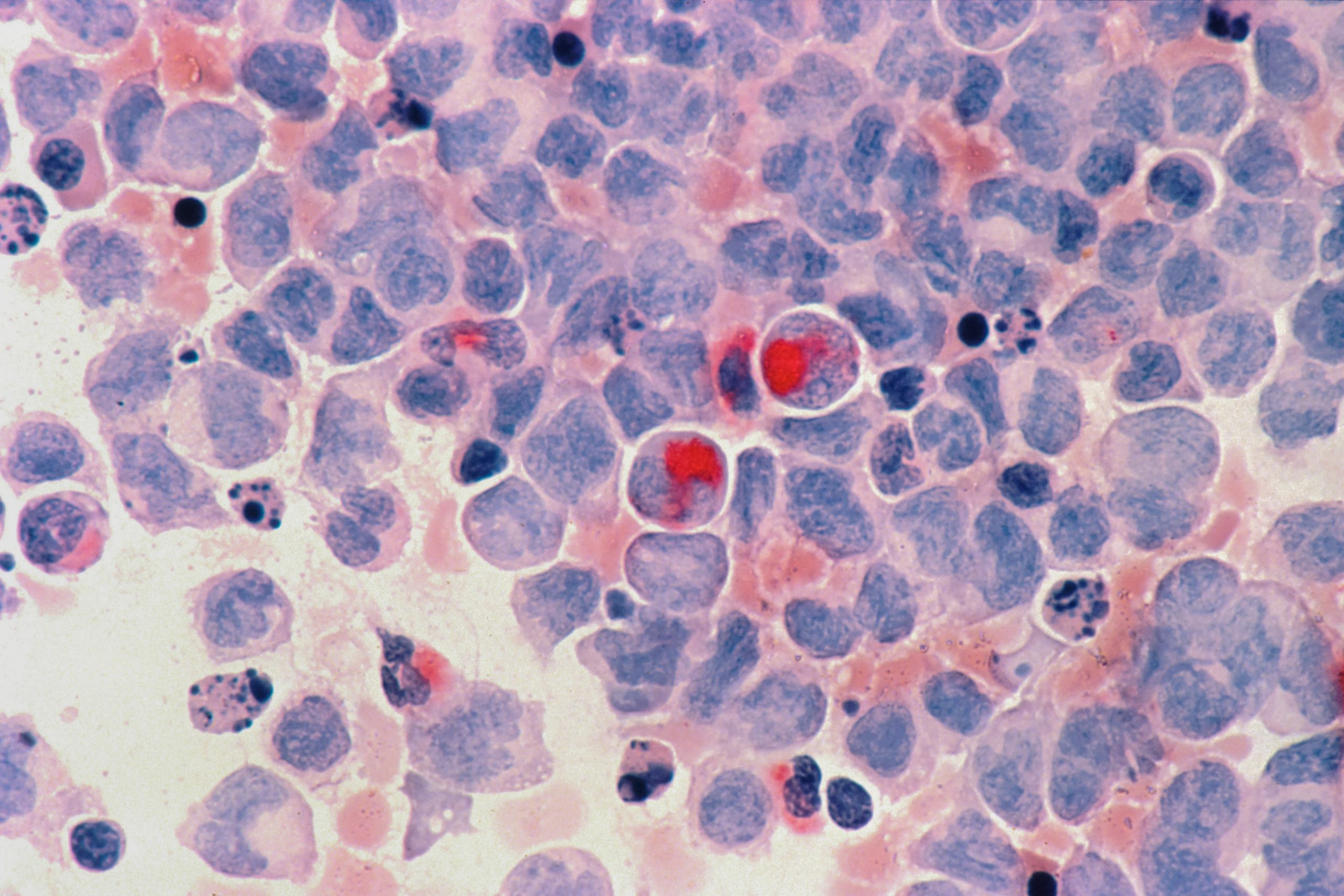
Perché, in circa la metà dei pazienti con leucemia mieloide acuta sottoposti a trapianto di midollo osseo, il tumore dopo un certo tempo torna? È la domanda che si sono posti Raffaella Di Micco, dell’Istituto San Raffaele Telethon per la terapia genica di Milano, e Luca Vago, dell’IRCCS Ospedale San Raffaele. Per trovare la risposta, i due ricercatori hanno unito gli sforzi dei propri gruppi, specializzati rispettivamente in studi di base e clinici. Hanno così scoperto un nuovo meccanismo che permette alle cellule leucemiche di rendersi “invisibili” al sistema immunitario, portando alla recidiva. I risultati della ricerca, resa possibile anche dal sostegno di Fondazione AIRC, sono stati pubblicati sulla rivista Cancer Discovery.
Il trapianto di midollo osseo da donatore compatibile fornisce ai pazienti, da un lato, cellule del sangue sane che possono sostituire le sue cellule malate e, dall’altro lato, cellule del sistema immunitario in grado di riconoscere e uccidere eventuali cellule leucemiche residue. Il riconoscimento avviene attraverso molecole specifiche presenti sulla superficie delle cellule tumorali e costituita da proteine dette HLA. «Se però il tumore si riorganizza, ‘nascondendo’ le proteine HLA, le cellule immunitarie del donatore non sono più in grado di riconoscerlo e compare la recidiva», spiega Di Micco. In alcuni casi questo accade in seguito a mutazioni nei geni codificanti per le proteine HLA, ma i ricercatori milanesi hanno scoperto che esiste anche un altro meccanismo in grado di donare questa “invisibilità”. Si tratta di un meccanismo epigenetico, che non riguarda le sequenze dei geni ma il modo in cui tali geni vengono espressi, per poi essere tradotti nelle proteine corrispondenti. Di Micco, Vago e colleghi hanno osservato che in pazienti con recidiva dopo il trapianto, la mancata produzione di proteine HLA può dipendere dall’attività di un complesso di proteine chiamato PRC2, che impedisce ai geni HLA di essere tradotti in proteine. Hanno inoltre osservato che, inattivando PRC2 con alcuni inibitori, le proteine HLA ricompaiono e le cellule tumorali tornano vulnerabili all’attacco immunitario. «Poiché questi inibitori sono già in sperimentazione clinica per altri tipi di tumore, la speranza è che si possa arrivare presto a uno studio clinico anche per la leucemia mieloide acuta», sottolinea Vago. La prospettiva decisamente promettente è stata resa possibile anche grazie agli studi in animali di laboratorio in cui è stata riprodotta in parte la malattia umana.
I ricercatori hanno lavorato con topi di laboratorio, nei quali è stato possibile per prima cosa aumentare il materiale genetico ottenuto dai pazienti. «Senza questo passaggio, non avremmo avuto materiale sufficiente per tutte le indagini che abbiamo svolto», spiega Di Micco. Gli animali, inoltre, sono stati necessari per valutare nel modo più realistico possibile l’effetto degli inibitori di PRC2. «Per farlo, occorre tenere conto della complessa relazione tra cellule tumorali, microambiente tumorale e sistema immunitario. Nonostante i tanti sforzi compiuti in tutto il mondo, questa relazione non può ancora essere ricostruita in modo soddisfacente al di fuori di un organismo completo. Rinunciare a lavorare con gli animali, oggi, significherebbe rallentare in modo notevole la possibilità di arrivare ai pazienti con nuove terapie sicure ed efficaci». Anche per queste ragioni gli studi negli animali sono una tappa della ricerca biomedica obbligatoria per legge, al fine di assicurare la sicurezza e l’efficacia di farmaci e trattamenti.